Warning: strpos() expects parameter 1 to be string, array given in /home/site/wwwroot/wp-content/themes/twentynineteen-child/functions.php on line 163
Por costumbre, los tumores se han clasificado según su origen anatómico y su histología. Por estas clasificaciones moleculares, el tratamiento para cada uno de ellos era el mismo, aunque se veía que las respuestas podían variar de unos casos a otros. Lo mismo sucede ahora con el cáncer de colon debido a que la epidemiología, las alteraciones genéticas y epigenéticas, las vías metabólicas y el pronóstico dependen de si el cáncer se origina en el lado derecho o izquierdo.

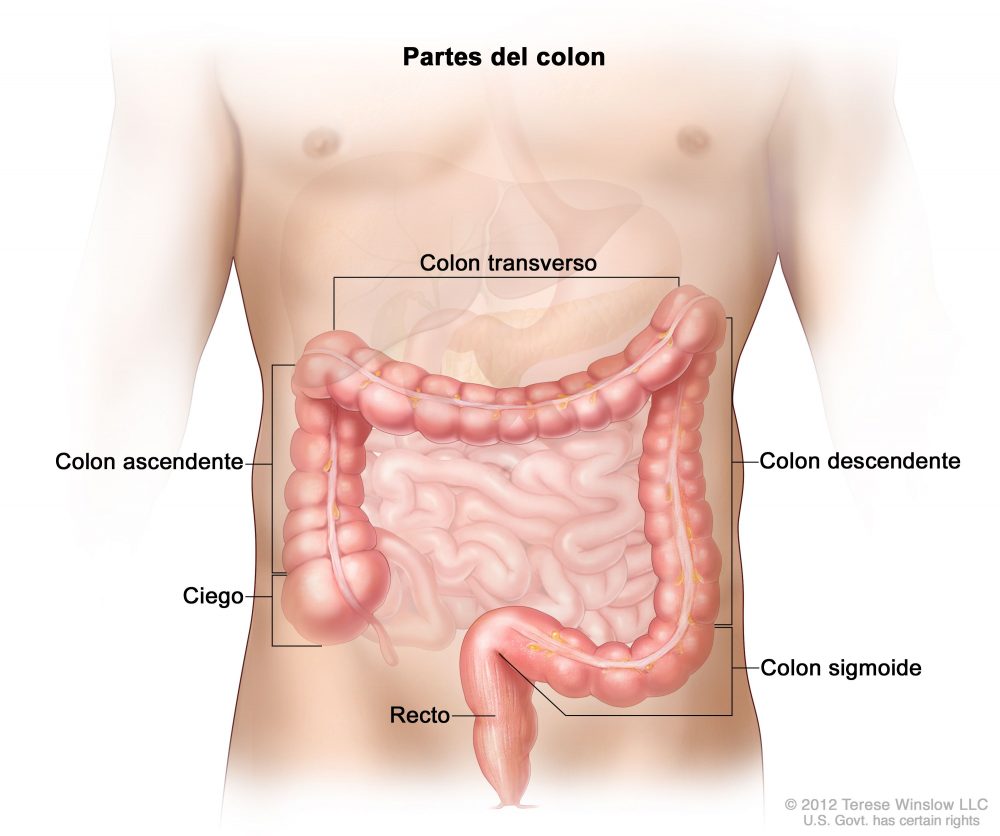
Diferencias entre colon derecho e izquierdo
Existen diferencias a múltiples niveles entre los tumores de colon derecho y los de colon izquierdo. Tiene su base en el propio desarrollo embriológico, funciones fisiológicas específicas y diferentes características genéticas e inmunológicas. Estas conllevan alteraciones moleculares diferentes implicadas en el proceso de la tumorogénesis. Por tanto, una presentación clínica y epidemiología propia de cada uno de ellos.
Se considera colon derecho desde ciego hasta 2/3 proximales del colon transverso. Por su parte, el colon izquierdo comprende desde 1/3 distal de colon transverso hasta recto.
Desarrollo embriológico y fisiología
El intestino primordial se forma durante la cuarta semana de vida por la incorporación de una porción del saco vitelino al embrión. Es consecuencia del plegamiento cefalocaudal y lateral durante el periodo somítico, formando un tubo endodérmico que consta de tres partes: intestino anterior, intestino medio e intestino posterior.
- Del intestino anterior se derivan: faringe primordial, vías respiratorias inferiores, esófago, estómago, duodeno distal, hígado y duodeno.
- Del intestino medio se derivan: intestino delgado, duodeno proximal, ciego, apéndice, colon ascendente, mitad o tercio de colon transverso.
- Del intestino posterior se derivan: mitad izquierda del colon transverso, colon descendente, colon sigmoides, recto y parte superior del canal anal. También derivan de él, el epitelio de la vejiga urinaria y la mayor parte de la uretra.
La vascularización del colon derecho y del izquierdo es también diferente como consecuencia de este mismo desarrollo embriológico. Durante la décima semana, el intestino medio (que había salido del abdomen) vuelve al mismo discurriendo junto con la arteria mesentérica superior (AMS). El intestino delgado, formado del extremo proximal, ocupa la parte central del abdomen. El intestino grueso, formado del extremo distal, ocupará la parte derecha del abdomen. El Intestino posterior va a estar vascularizado por la arteria mesentérica inferior (AMI).
Es por ello que el colon derecho está irrigado por ramas de la AMS y el colon izquierdo y recto por ramas tributarias de la AMI. También se sabe que el colon derecho es metabólicamente más activo, como el resto de órganos derivados del intestino medio. Mientras tanto, el izquierdo actúa más como reservorio, como le ocurre a las estructuras derivadas del intestino posterior. Fruto de esta actividad metabólica, la flora bacteriana resulta ser más abundante en el colon derecho.
Genética y epigenética
Se conocen alrededor de 1000 genes relacionados con la patogénesis del CCR. Alrededor de un 70% de estos genes se expresan en los cánceres de colon distal y un 30% en los de colon proximal. Como mecanismos mutacionales asociados al CCR, se hallan los epigenéticos como la metilación del DNA (CIMP) y la inestabilidad genómica. Esta última se divide en inestabilidad cromosómica (CIN) e inestabilidad de microsatélite (IMS).
La mayoría de las alteraciones presentes en los tumores distales son por inestabilidad cromosómica. Por esto las mutaciones más características son las de KRAS y P53, mientras que en los tumores origen derecho presentan predominantemente IMS. CIN es el mecanismo que más comúnmente ocurre en el CCR esporádico (70-85%) y es también conocido como la vía supresora. Conlleva la pérdida de heterocigosidad de genes supresores de tumor y mutaciones de protooncogenes.
La IMS, conocida como la vía mutadora, es causada por errores en el sistema de reparación por daño del DNA. Se da principalmente por fallo en la complementariedad de las bases. Esto genera la expansión de secuencias cortas en tándem y un aumento en el número de mutaciones.
Inmunología
Es conocido que en el adulto sano existe una mayor actividad inmunológica en el ciego respecto al recto. Además presenta mayores niveles de inflamación, una mayor proporción de células eosinófilas y linfocitos-T intraepiteliales.
Los tumores originados en el lado derecho estarían expuestos a una mayor actividad inmunológica respecto a los tumores izquierdos. Se sabe que los tumores con IMS son más frecuentemente de origen proximal. Una de sus principales características es que presentan alta infiltración por linfocitos infiltrantes de tumor (TILs), lo cual podría estar parcialmente explicado por la mayor inmunogenicidad presente en la mucosa del colon proximal respecto al distal.
Composición molecular
Se estima que hasta el 80% de los CCR esporádicos son debidos a inestabilidad cromosómica. Es caracterizada por la activación del oncogén KRAS y pérdida de la supresión de genes APC, SAMD4 y p53. Presentan estabilidad de microsatélites y fenotipo no hipermetilado, lo cual es característico de los tumores de origen izquierdo, especialmente el cáncer de recto.
En los tumores más proximales, son características las mutaciones de BRAF y la hipermetilación aberrante de citosina-guanosina. Los tumores resultantes son usualmente positivos para IMS debido al silenciamiento epigenético del gen MLH. Las mutaciones en BRAF raramente se ven en el Síndrome de Lynch. Constituyen un marcador para diferenciar entre tumores hereditarios con IMS de tumores hipermetilados con IMS.
Estos cambios entre colon derecho e izquierdo no son tan abruptos. Algunos autores describen cómo los tumores con mutaciones de BRAF+/IMS+/hipermetilación+; aumentan desde el recto hasta el colon ascendente con un cambio más marcado en la flexura esplénica, volviendo a disminuir su frecuencia a nivel del ciego.
Presentación clínica
Se sabe del análisis de estudios epidemiológicos que existen diferencias en la presentación y curso clínico del carcinoma colorectal, dependiendo de su localización. A continuación, se verá cuales son algunas de estas diferencias:
- Colon derecho:
- Incidencia: 40%, aunque está aumentando en los últimos años.
- Pacientes mayores.
- Síntomas más sutiles, más larvados.
- Más frecuente en mujeres.
- Tumores de alto grado y de mayor tamaño.
- Diseminación peritoneal.
- Subtipo mucinoso.
- Estadios más avanzados o tumores sincrónicos.
- Peor pronóstico.
- Colon Izquierdo:
- Incidencia: 60%, tendencia decreciente.
- Pacientes más jóvenes.
- Más frecuente en hombres.
- Menor estadiaje TNM.
- Más frecuentes metástasis a distancia.
- Mejor pronóstico.
Clasificación del cáncer colorectal (CCR)
El CCR es una enfermedad compleja y heterogénea desde el punto de vista biológico. Los esfuerzos en determinar el perfil molecular tienen como fin comprender mejor los mecanismos que determinan el comportamiento clínico de los diferentes tumores. De esta manera, identificar biomarcadores que proporcionen información pronostica precoz. En base a ello, se podría confeccionar un tratamiento personalizado.
Existían varias clasificaciones del CCR atendiendo al perfil molecular. Se ha intentado unificarlas para facilitar la investigación traslacional formando un consorcio internacional, The Colorectal Cancer Subtyping Consortium (CRCSC) en el año 2015. Integra a los grupos más importantes que han compartido sus casos (4562), sus análisis biológicos y sus clasificaciones previas (seis diferentes clasificaciones previas). Genera una única clasificación, la del consenso de subtipos moleculares (consensus molecular subtypes –CMSs-). De esta manera establece cuatros subgrupos de consenso, según sus características clínico-patológicas, vías moleculares implicadas y estado mutacional de los genes KRAS, BRAF y PI3KCA.
Nuevas dianas terapéuticas
Es bien conocido que el tratamiento estándar del carcinoma de colon en primera o segunda línea consiste en combinaciones de fluoropirimidinas con Oxaliplatino o Irinotecan (FOLFOX/CAPOX o FOLFIRI/CAPIRI). Se añade un fármaco biológico dirigido antiangiogénico (Bevacizumab o Aflibercept) o bien antiEGFR en aquellos pacientes con RAS nativo (Cetuximab o Panitumumab). Hoy en día son conocidas nuevas mutaciones que constituyen nuevas dianas terapéuticas. Se basan en las diferencias moleculares hasta ahora comentadas:
BRAF
Casi todas las mutaciones de BRAF son del tipo V600E y van a ser excluyentes de mutaciones RAS. Está presente entre el 5-10% de los casos de CCR, más frecuentemente en mujeres, ancianos
y en colon proximal. Se suele asociar a tumores indiferenciados e IMS. Provoca la activación de la vía EGFR, haciendo que estos tumores no respondan a terapias con antiEGFR.
Basado en estudios retrospectivos y en estudios prospectivos, pero de escaso número de pacientes, el tratamiento más recomendado en estos pacientes consiste en el triplete FOLFOXIRI + Bevacizumab. Incluso si la evidencia no es robusta y se requeriría de una mayor investigación.
Además, y al contrario de lo que ocurre en pacientes con melanoma con BRAF mutado, los CCR metastásicos portadores de esta mutación se muestran resistentes a la combinación de fármacos antiBRAF e inhibidores de MEK. La resistencia a estos fármacos tiene que ver con la retroactivación de EGFR al inhibir la vía de BRAF.
HER-2
Su amplificación está presente en el 3-4% de CCRm y su mutación en el 1-2% de los pacientes. Esta amplificación resulta en peores respuestas y menor supervivencia libre de progresión con la terapia antiEGFR. A pesar de estas implicaciones negativas, puede constituir una nueva diana terapéutica. En el estudio HERACLES, se han comunicado tasas de respuestas objetivas del 30% (y duración de 9,5 meses), de la combinación con trastuzumab y lapatinib en pacientes politratados y amplificación de Her-2, y tasa de control de enfermedad del 78%. Estas respuestas se dan más frecuentemente (85%) en colon izquierdo y recto. Además parece ser que la amplificación de Her-2 ocurre en las etapas iniciales, existiendo concordancia entre el tumor primario y la metástasis. De forma similar, en un estudio basket se han reportado tasas de respuesta del 23% con la combinación de trastuzumab y pertuzumab.
Inestabilidad de microsatélites
Las deficiencias en los mecanismos de reparación del DNA conllevan a la expansión de elementos repetitivos a lo largo del genoma llamado IMS. Están presentes en aproximadamente el 15% de todos los CCR, siendo en un 4% heredado por mutaciones germinales en MLH1, MSH2, MSH6 y PMS2 como parte del síndrome de Lynch. El resto ocurren por mutaciones somáticas, la mayor parte debidas a hipermetilaciones del promotor de MLH1.
En los casos en los que se haya detectado ausencia de algunas de estas proteínas, y por tanto de IMS, si se quiere tratar de diferenciar entre síndrome de Lynch y CCR esporádico, la presencia de BRAF mutado ocurre casi exclusivamente en los casos esporádicos. Mientras tanto, su estado nativo podría orientar hacia un posible síndrome hereditario. Por ende, esa familia debería ser remitida para consejo genético.
La presencia de IMS alta tiene implicaciones pronosticas y predictivas en pacientes con CCR: En estadios II aportan buen pronóstico con mayores supervivencias tras resección quirúrgica. No necesitan tratamiento adyuvante con fluoropirimidinas. En estadios IV (presente en el 4-5% de los pacientes) confiere mal pronóstico, pero es predictiva de respuesta a los tratamientos con inmunoterapia.
Estudios oncológicos

Sabiendo que la tasa de pacientes con cáncer ha incrementado considerablemente en los últimos años, y que cada uno de los tumores presentes en el organismo deben ser tratados de una forma específica, TECH Universidad Tecnológica se une a la lucha contra el cáncer ofreciendo posgrados de alta calidad con el fin de brindar herramientas de profundización a los profesionales.
Programas como el Máster en Oncología Torácica o el Máster en Oncología Neurológica demuestran de manera breve la variedad que tiene el cáncer cuando se manifiesta en el cuerpo humano. Para el tratamiento de esta patología degenerativa es fundamental que el área médica, tanto de investigación como de intervención directa, posea más especialistas en el abordaje de temas como el desarrollado a lo largo del Máster en Oncología Digestiva.
