Warning: strpos() expects parameter 1 to be string, array given in /home/site/wwwroot/wp-content/themes/twentynineteen-child/functions.php on line 163
El cabello está compuesto, en su mayor parte, por una proteína fibrosa: la queratina. Así mismo, gracias a las más recientes investigaciones en el tema, se ha encontrado que también contiene la presencia de carbono, hidrógeno, oxígeno, nitrógeno y azufre. Todos estos elementos desempeñan un papel fundamental en la composición química del cabello, así como en su pigmentación y salud capilar.

Queratinas
El término queratina procede del vocablo griego “keros”, que quiere decir cuerno. Tiene su raíz en el olor a cuerno quemado que emana cuando se quema. La queratina es una proteína helicoidal. Hay dos tipos de fibras de queratina que existen en el cabello: tipo I con residuos de aminoácidos ácidos y tipo II con residuos amino básicos.
La queratina es una proteína que presenta una estructura secundaria. Es decir, la serie macromolecular con cierta secuencia primaria, se dobla sobre sí misma, logrando tres dimensiones. Dicha disposición puede ser de clase helicoidal, catalogándose de esta manera proteína α-hélice o de forma de lámina o lámina-β.
Las interrelaciones entre moléculas de clase fuerzas hidrofóbicas, puentes de hidrógeno o enlaces salinos (como los desarrollados entre el ácido glutámico) los aminoácidos y lisina pueden conservar enlazados los aminoácidos de las diferentes hebras o los fragmentos macromoleculares de la proteína.
La queratina es una sustancia de alto peso molecular que se forma como producto final del proceso de queratinización que tiene lugar en el folículo. Una hebra de fibra tipo I y una hebra de fibra tipo II forman una espiral para formar dímeros de espiral enrollada. A su vez, estos dímeros se enrollan juntos de manera antiparalela para formar tetrámeros.
Dura y blanda
Dependiendo del contenido de azufre que tengan, las α-queratinas pueden clasificarse como queratinasblandas o queratinas duras. Ello tiene que ver con la fuerza de resistencia mecánica que imponen los enlaces disulfuro en la estructura proteica. La queratina se encuentra constituida fundamentalmente por un aminoácido de elevado nivel de azufre. Las queratinas duras poseen entre 15% y 18% de azufre, en tanto que las blandas únicamente presentan entre 2% y 4% de azufre.
Las queratinas colaboran en formar los tejidos de las uñas, del cabello y la capa externa de la piel. Además, se hallan en las células que revisten las glándulas, los órganos, y otras partes del organismo. La queratina en las uñas se distingue de la queratina dela piel porque en esta es blanda, en tanto que en las uñas es dura. Esta rareza es debida a que la queratina en las uñas es materia muerta, aunque cumple una labor de protección con relación al medio.
Química
La solidez del enlace peptídico facilita que las proteínas acojan figuras tridimensionales bien determinadas. La autonomía de giro de los dos lados de la unidad peptídica es también significativa porque posibilita a las proteínas doblar de formas muy distintas. Las proteínas se organizan en el espacio conformando una estructura de tres dimensiones que pueden presentar hasta cuatro niveles de organización: estructura primaria, secundaria, terciaria y cuaternaria
Primaria
Es la serie lineal de aminoácidos que componen una proteína. Es decir, muestra la cantidad y la clase de aminoácidos que la forman y la disposición en que se hallan enlazados.
La estructura primaria de las proteínas se encuentra definida en la información genética, y las uniones que conservan su equilibrio son enlaces peptídicos. El cotejo de secuencias de diferentes proteínas admite sentar interrelaciones evolutivas entre especies. La estructura primaria de las proteínas es rectilínea y se torna tridimensional al doblarse.
Secundaria
Se trata de la distribución normal y periódica en el espacio de las cadenas polipeptídicas en una orientación. El plegado propio de este tipo de disposición está definido por la serie de aminoácidos, y la dureza del enlace peptídico, que solamente permite giros alrededor de los enlaces sencillos. El equilibrio de esa estructura es viable gracias a los puentes de hidrógeno que se crean entre los grupos amino y carboxilo.
Es la estructura secundaria más estándar. En ella, la cadena polipeptídica se va plegando en espiral sobre sí misma, por los giros que se originan alrededor del carbono α de cada aminoácido.
Características
A continuación, se exponen algunas características más importantes de estas estructuras:
- Se crean puentes de hidrógeno intracatenarios, entre el grupo (CO de un aminoácido y el grupo) NH del aminoácido ubicado 4 restos luego.
- Existe 3’6 aminoácidos por cada vuelta de hélice, cada aminoácido rota 100o respecto al anterior.
- Se genera un adelanto por residuo de 1’5 Å, por lo que el paso de rosca de 5’4 Å.
- La rotación en las hélices α que se hallan en las proteínas es dextrógiro (sentido de las agujas del reloj).
- Los grupos carboxilo permanecen orientados enla misma dirección, en tanto que los amino sedirigen a la dirección contraria. Los radicales de los aminoácidos quedan orientados al exterior de la α–hélice.
- Los residuos de prolina e hidroxiprolina desequilibran la α–hélice, ya que estos aminoácidos frenan la formación de enlaces de hidrógeno.
Hoja plegada o B-laminar
En esta clase de estructura secundaria la cadena polipeptídica se dobla de forma que los planos de los enlaces peptídicos se distribuyen en forma de zigzag. La interacción con otros segmentos de la cadena con conlleva a la conformación de láminas u hojas, en vez de estar angostamente enrollada como en el caso de la hélice α. En ella ocurre lo siguiente:
- Se crean puentes de hidrógeno intercatenarios, en- tre grupos –NH y –CO de filamentos polipeptídicos distintos.
- Las secuencias laterales se ubican alternativamente por arriba y por debajo del plano de la lámina.
- Cada residuo de aminoácido abarca 3’5 Å. Las cadenas contiguas en una hoja doblada β pueden dirigirse en igual dirección (hojas β paralelas) o en direcciones contrapuestas (hojas β antiparalelas). En los dos casos, los radicales de los aminoácidos se sitúan hacia los dos lados de la hoja, de forma alterna. La distribución antiparalela es un tanto más compacto que la paralela, y figura con mayor periodicidad en las proteínas. Como se puede evidenciar, es requerido incorporar giros o codos en las cadenas polipeptídicas que igualmente se equilibran por los puentes de hidrógeno.
Terciaria
Esta determina la figura tridimensional que logra una cadena polipeptídica. Es decir, la forma en que una proteína se halla doblada en el espacio. La estructura tridimensional supedita la labor de la proteína. En ella se pueden reconocer grupos de menor volumen que se denominan dominios. La concepción de dominio es de mucha utilizad al exponer la relación entre estructura y función en las proteínas, ya que dominios individuales poseen labores características en más de una proteína.
En la disposición espacial de una proteína, incide la tendencia de las cadenas laterales hidrófobas de los aminoácidos a conservarse a lo interno de la proteína; adquiriendo la figura termodinámicamente más firme en ese medio. La proteína puede experimentar cambios de conformación en el ejercicio de la función y en el control de la actividad. La estructura terciaria se equilibra a través de enlaces que se crean entre definidos grupos de las cadenas laterales:
- Enlaces o puentes de hidrógeno: llevados a cabo entre cadenas laterales de aminoácidos polares sin carga. Son de suma importancia en vista de su profusión.
- Atracciones electrostáticas: o interrelaciones iónicas, entre grupos carboxilo y amino, de aminoácidos ácidos y bases.
- Atracción hidrofóbica y fuerzas de Van der Waals: entre radicales alifáticos y aromáticos de las cadenas laterales de los aminoácidos apolares.
- Puentes disulfuro: enlaces covalentes –S–S–, más fortalecidos que los anteriores, entre dos grupos – SH de dos cisteínas (o derivados).
- Enlaces coordinados: entre cationes de metales detransición, y la proteína.
Cuaternaria
Figura en las proteínas compuestas por más de una subunidad o protómero. Esta estructura refiere a esa agrupación de protómeros para crear la proteína biológicamente dinámica. Los protómeros pueden acoplarse frágilmente entre sí mediante uniones de hidrógeno o fuerzas de van der Waals. En ciertos casos, si bien no es usual, este enlace puede establecerse a través de puentes disulfuro.
Esta formación únicamente la muestran las proteínas oligoméricas, que poseen dos o más cadenas polipeptídicas, iguales o no, cada una de las cuales tiene su propia configuración secundaria y terciaria.
De esta manera, en la queratina del pelo se crean tres hebras. Cada una de ellas está compuesta por un arrollamiento α–hélice. Por su parte, las cuatro cadenas polipeptídicas globulares de la hemoglobina se acoplan y adquieren una configuración cercana a un tetraedro, que compone la estructura cuaternaria de la hemoglobina.
En un nivel todavía mayor se halla la agrupación entre proteínas y moléculas no proteínicas como lípidos, glúcidos y ácidos nucleicos.
A-Queratinas
La alfa queratina revela en sus series de aminoácidos, residuos (monómeros) de cisteína, que componen puentes disulfuro, lo que se llama grupo cistina. Los puentes disulfuro suministran la rigidez y tenacidad a la queratina alfa. De esta manera hay más número de enlaces cistina (disulfuro) en zonas estructurales de los cuernos de un animal y en el pelo o las uñas. La queratina alfa se halla en pelos, cuernos, uñas y otras faneras.
Este tipo de queratina es el más estudiado y se sabe quelos mamíferos tienen al menos 30 variantes distintas de este tipo de queratinas. Al igual que el colágeno, estas proteínas contienen ensu estructura una abundante proporción de aminoácidospequeños como la glicina y la alanina, que son los que hacen posible el establecimiento de las hélices alfa. La estructura secundaria de la α-queratina es muy parecida a la de las típicas proteínas en hélice alfa(figura 6) y forma una hélice superenrollada.
Queratina Beta
La beta queratina no contiene cisteína, o la presenta en muy baja cantidad, por ello tiene pocos entrecruzamientos Inter macromoleculares mediante puentes disulfuro (cistina). No obstante, la queratina de tipo beta, muestra mayor cantidad de plegamientos de forma lámina-β.
Se encuentra presente en aves y reptiles. La elevada cohesión lograda por el elevado número de asociaciones por puentes de hidrógeno de las láminas-β, produce que la presencia de queratina-β surja en sustancia de gran firmeza tales como la seda de araña.
Lípidos
El contenido lipídico del pelo humano es distinto que el de la epidermis. A nivel de todo el folículo, está compuesto, en orden decreciente, por ácidos grasos, fitoesfingosina, ceramida, colesterol y sulfato de colesterol, con variaciones en la VPI (el oleato de colesterol reemplaza al sulfato de colesterol) y en las estructuras internas a esta (la fitoesfingosinatoma es un lugar preponderante).
Los ácidos grasos no esterificados son abundantes en la cutícula y la corteza, y un 30% a un 40% de estos corresponden al ácido 18-metileicosaenoico. Presenta uniones éster o tioéster con las proteínas de las células vivas o queratinizadas. Los tratamientos alcalinos como tinturas, decoloraciones, permanenteso la luz solar pueden llevar a la pérdida de ácido 18-metileicosaenoico. En consecuencia, el pelo se vuelve seco y quebradizo y pierde elasticidad y brillo.
Oligoelementos
Son bioelementos presentes en pequeñas cantidades en los seres vivos, tanto su ausencia como su exceso puede ser perjudicial para el organismo. Resultan de vital importancia para la salud y la composición de estos. La falta de hierro ocasiona un tipo de alopecia en muchas mujeres.
Pigmentos
El color del cabello viene de la melanina, sustancia que le da al pelo y a la piel su pigmento. Existen tres tipos de melaninas:
- Eumelaninas: va desde el color marrón al negro.
- Feomelaninas: va desde el color amarillo al rojo.
- Tricocromo: de color rojizo.
La mezcla y cantidades de estos pigmentos determinan el color natural del pelo. En alguna forma tambiénes cierto que mientras más claro sea un pelo menos melanina tiene. Una persona con cabello negro tiene mucha más melanina que alguien con pelo rubio o rojo. El color del pelo es una característica individual que está determinada genéticamente, como otros rasgos raciales tales como la coloración de los ojos o la pigmentación cutánea.
La disposición y cantidad de estas melaninas proporcionan las diferentes tonalidades de pelo, por lo que el color del cabello se debe a la presencia de gránulos de melanina elaborados del bulbo capilar y distribuido en los queratinocitos del tallo, de forma similar a lo que ocurre en la epidermis. En cada cabello hay varios tipos de pigmentos y el color resultante depende delas cantidades de cada uno de ellos, de la cantidad, deltamaño y de su distribución en el córtex.
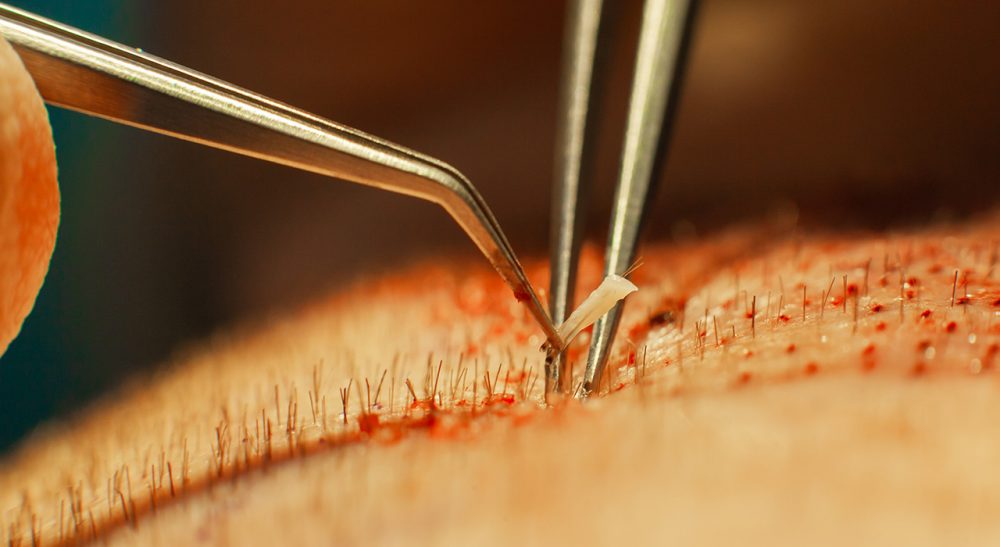
Trasplante capilar

En el contexto de una sociedad cada vez más preocupada de su imagen, TECH Universidad Tecnológica adquiere una gran importancia. Se configura como una herramienta de altísimo interés gracias al repertorio de programas dermatológicos y estéticos que ofrece: el Máster en Dermatología Clínica y el Máster en Antiaging son sólo un par de ejemplos.
Al trabajar en esta área, el estudiante que se inscriba a cualquiera de los programas mencionados, a este Máster en Trasplante Capilar o a alguno de los que aparece disponible en la página de TECH, logrará aprender de los mejores expertos de dicho ámbito. Aquí encontrarás la capacitación más completa, actualizada y accesible del mercado docente online gracias a la mejor tecnología educativa que se utiliza.